Faradayove zákony elektrolýzy
Faradayove zákony elektrolýzy sú kvantitatívne vzťahy založené na elektrochemickom výskume Michaela Faradaya, ktorý publikoval v roku 1836.
Tieto zákony určujú vzťah medzi množstvom uvoľnených látok počas elektrolýzy a množstvo elektriny prejdenej cez elektrolyt. Faradayove zákony sú dva. Vo vedeckej literatúre a v učebniciach existujú rôzne formulácie týchto zákonov.
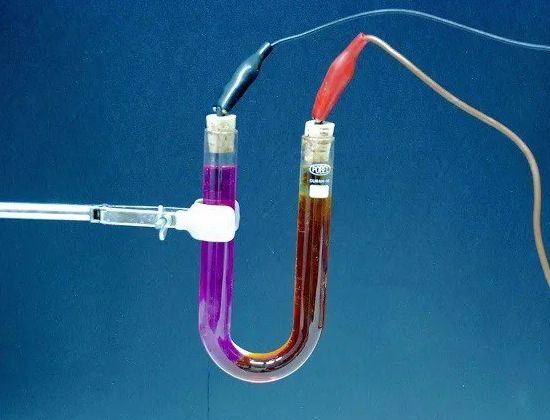
Elektrolýza — uvoľnenie základných látok z elektrolytu počas prechodu elektriny… Napríklad, keď elektrický prúd prechádza mierne okyslenou vodou, voda sa rozkladá na jej zložky – plyny (kyslík a vodík).
Množstvo látky uvoľnenej z elektrolytu je úmerné množstvu elektriny prechádzajúcej elektrolytom, teda súčinom sily prúdu krát času, počas ktorého tento prúd preteká. Preto fenomén elektrolýzy môže slúžiť na meranie sily prúdu a určenie aktuálne jednotky.
Elektrolyt — roztok a vo všeobecnosti zložitá kvapalina, ktorá vedie elektrický prúd.V batériách je elektrolytom roztok kyseliny sírovej (v olove) alebo roztok hydroxidu draselného alebo lúhu sodného (v železo-niklu). V galvanických článkoch slúžia ako elektrolyt aj roztoky akýchkoľvek chemických zlúčenín (amoniak, síran meďnatý atď.).
Michael Faraday (1791 - 1867)
Michael Faraday (1791 — 1867) — anglický fyzik, zakladateľ modernej doktríny elektromagnetických javov. Svoj pracovný život začal ako učeň v knihárskej dielni. Získal len základné vzdelanie, ale samostatne študoval vedu a pracoval ako laborant u chemika Deviho, stal sa skvelým vedcom, jedným z najväčších experimentálnych fyzikov.
Farraday otvoril fenomén elektromagnetickej indukcie, zákony elektrolýzy, rozvinul doktrínu elektrických a magnetických polí a položil základy moderných koncepcií elektromagnetického poľa... Bol prvým vedcom, ktorý mal predstavu o vibračnej, vlnovej povahe elektromagnetických javov.
Prvý Faradayov zákon elektrolýzy
Hmotnosť látky, ktorá sa vyzráža na elektróde počas elektrolýzy, je priamo úmerná množstvu elektriny prenesenej na túto elektródu (prejdenej cez elektrolyt). Množstvo elektriny sa vzťahuje na množstvo elektrického náboja, zvyčajne merané v príveskoch.
Druhý Faradayov zákon elektrolýzy
Pre dané množstvo elektriny (elektrického náboja) je hmotnosť chemického prvku, ktorý sa usadí na elektróde počas elektrolýzy, priamo úmerná ekvivalentnej hmotnosti tohto prvku. Ekvivalentná hmotnosť látky je jej molárna hmotnosť vydelená celým číslom v závislosti od chemickej reakcie, na ktorej sa látka zúčastňuje.
Alebo
Rovnaké množstvo elektriny vedie k uvoľneniu ekvivalentných hmotností rôznych látok na elektródach počas elektrolýzy. Na uvoľnenie jedného mólu ekvivalentu akejkoľvek látky je potrebné minúť rovnaké množstvo elektriny, a to 96485 C. Táto elektrochemická konštanta je tzv. Faradayovo číslo.
Faradayove zákony v matematickej forme
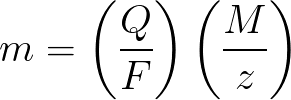
-
m je hmotnosť látky nanesenej na elektróde;
-
Q je hodnota celkového elektrického náboja v príveskoch, ktorý prešiel počas elektrolýzy;
-
F = 96485,33 (83) C / mol – Faradayovo číslo;
-
M je molárna hmotnosť prvku v g/mol;
-
z — valenčný počet iónov látky (elektróny na ión);
-
M/z — ekvivalentná hmotnosť látky aplikovanej na elektródu.
Aplikované na prvý Faradayov zákon elektrolýzy, M, F a z sú konštanty, takže čím viac Q, tým viac m bude.
Z hľadiska druhého Faradayovho zákona elektrolýzy sú Q, F a z konštanty, takže čím viac M / z, tým viac m bude.
Pre jednosmerný prúd máme
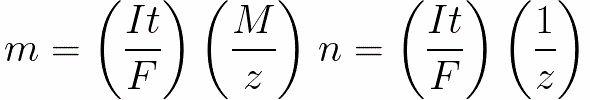
-
n je počet mólov (množstvo látky) uvoľnených na elektróde: n = m / M.
-
t je čas prechodu jednosmerného prúdu cez elektrolyt. V prípade striedavého prúdu sa celkový náboj spočítava v priebehu času.
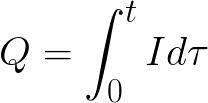
-
t je celkový čas elektrolýzy.
Príklad aplikácie Faradayových zákonov
Je potrebné napísať rovnicu elektrochemických procesov na katóde a anóde pri elektrolýze vodného roztoku síranu sodného s inertnou anódou. Riešenie problému bude nasledovné. V roztoku bude síran sodný disociovať podľa nasledujúcej schémy:
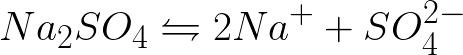
Štandardný elektródový potenciál v tomto systéme je nasledovný:
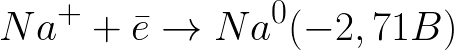
Toto je oveľa negatívnejšia úroveň potenciálu ako pre vodíkovú elektródu v neutrálnom médiu (-0,41 V). Preto na zápornej elektróde (katóde) začne elektrochemická disociácia vody uvoľňovaním vodíka a hydroxidového iónu podľa nasledujúcej schémy:
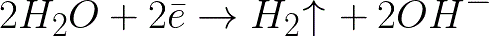
A kladne nabité ióny sodíka blížiace sa k záporne nabitej katóde sa budú hromadiť v blízkosti katódy v susednej časti roztoku.
Na kladnej elektróde (anóde) dôjde k elektrochemickej oxidácii vody, ktorá povedie k uvoľneniu kyslíka podľa nasledujúcej schémy:
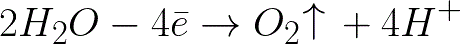
V tomto systéme je štandardný elektródový potenciál +1,23 V, čo je výrazne pod štandardným elektródovým potenciálom v nasledujúcom systéme:
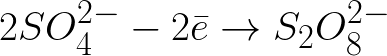
Záporne nabité síranové ióny pohybujúce sa smerom ku kladne nabitej anóde sa budú hromadiť v priestore blízko anódy.

